O Que É Reação Quimica Exemplos – O Que É Reação Química: Exemplos e Conceitos é um tópico fundamental na química, explorando as transformações da matéria e as interações entre as substâncias. Reações químicas ocorrem constantemente ao nosso redor, desde a queima de combustíveis até a digestão de alimentos.
Compreender os princípios básicos das reações químicas é essencial para entender o mundo que nos cerca e para avançar em diversas áreas, como a medicina, a indústria e a agricultura.
Nesta discussão, iremos mergulhar no conceito de reações químicas, analisando as mudanças que ocorrem durante o processo, os elementos chave envolvidos, os diferentes tipos de reações e os exemplos práticos que ilustram esses conceitos.
O que são reações químicas?
As reações químicas são processos que envolvem a reorganização de átomos e moléculas, resultando na formação de novas substâncias com propriedades diferentes das originais. Essas transformações são essenciais para a vida e para a indústria, ocorrendo constantemente ao nosso redor.
Reações químicas: mudanças e exemplos
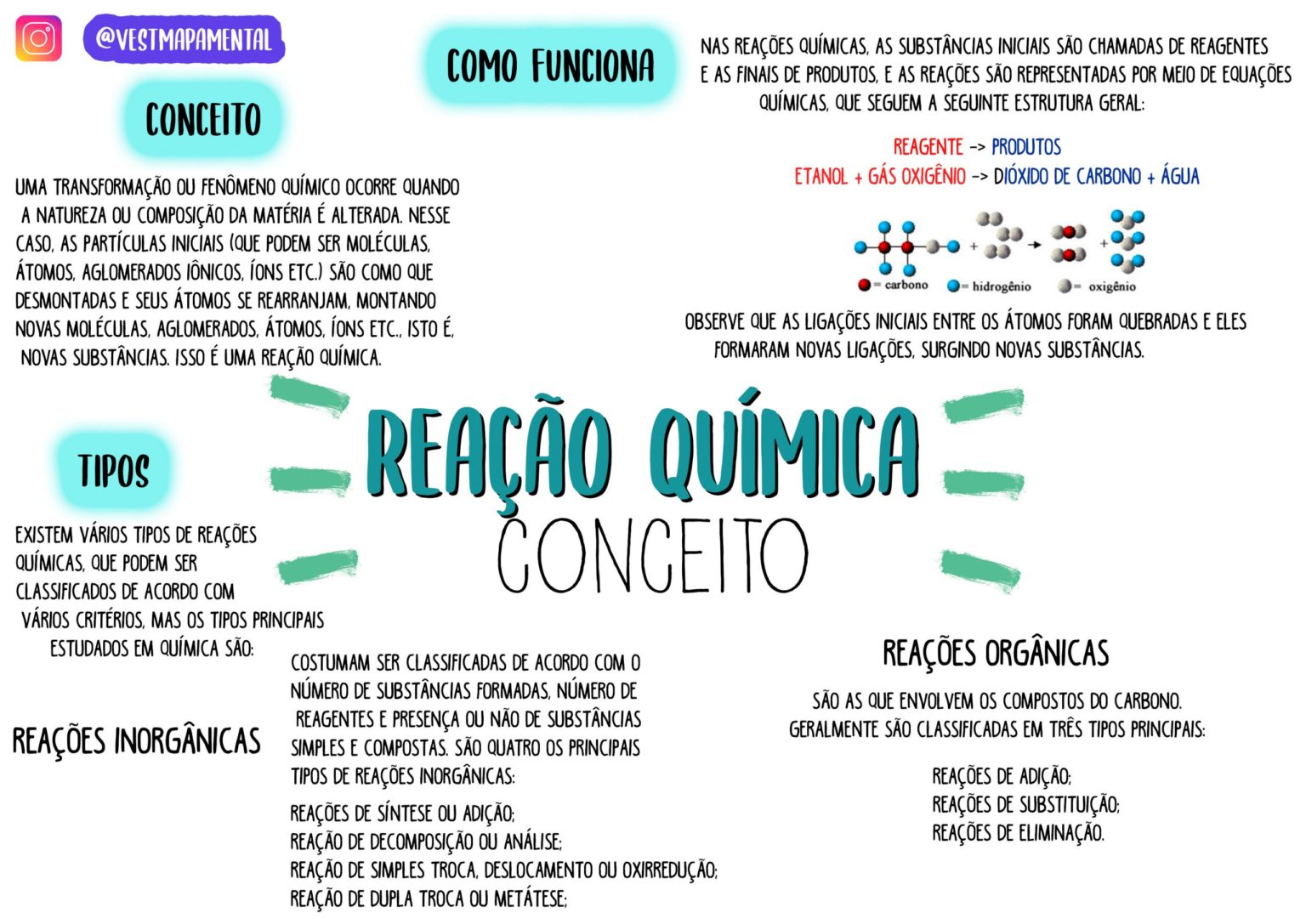
As reações químicas envolvem a quebra de ligações químicas entre átomos e a formação de novas ligações, levando à mudança na composição e estrutura das substâncias. Essa reorganização pode ser representada por equações químicas, que mostram os reagentes (substâncias iniciais) e os produtos (substâncias formadas).
Por exemplo, a reação de combustão da madeira pode ser representada pela seguinte equação:Madeira + Oxigênio → Dióxido de carbono + Água + Calor e Luz Nessa reação, a madeira e o oxigênio reagem, quebrando suas ligações e formando novas ligações, resultando na produção de dióxido de carbono, água, calor e luz.
- Queima de madeira:A madeira, composta principalmente por celulose, reage com o oxigênio do ar, liberando energia na forma de calor e luz, formando dióxido de carbono e água.
- Ferrugem em um prego:O ferro metálico reage com o oxigênio e a água do ambiente, formando óxido de ferro hidratado, conhecido como ferrugem. A ferrugem é um processo de corrosão que fragiliza o metal.
- Cozimento de um bolo:Durante o cozimento, os ingredientes do bolo, como farinha, açúcar e ovos, sofrem transformações químicas. O calor do forno faz com que as proteínas do ovo coagulem, o amido da farinha gelifique e o açúcar caramelize, resultando na textura e sabor característicos do bolo.
Elementos chave de uma reação química: O Que É Reação Quimica Exemplos
Uma reação química é um processo que envolve o rearranjo de átomos e moléculas, resultando na formação de novas substâncias com propriedades diferentes das originais. Para entender melhor as reações químicas, é crucial conhecer os elementos chave que as compõem.
Reagentes e produtos
Reagentes são as substâncias que entram em uma reação química, enquanto produtos são as substâncias que são formadas como resultado da reação. Em uma reação química, os reagentes são transformados em produtos por meio da quebra e formação de ligações químicas.
Por exemplo, na reação de combustão do metano (CH4) com oxigênio (O 2), os reagentes são metano e oxigênio, e os produtos são dióxido de carbono (CO 2) e água (H 2O):CH 4+ 2O 2→ CO 2+ 2H 2O
Ligações químicas e sua quebra e formação
Uma ligação química é a força de atração que mantém os átomos unidos. As ligações químicas podem ser iônicas, covalentes ou metálicas, e sua natureza influencia as propriedades das substâncias. Durante uma reação química, as ligações químicas nos reagentes são quebradas e novas ligações são formadas para gerar os produtos.
A quebra de ligações químicas requer energia, enquanto a formação de ligações químicas libera energia.
Por exemplo, na reação de formação da água, duas moléculas de hidrogênio (H2) reagem com uma molécula de oxigênio (O 2) para formar duas moléculas de água (H 2O). A ligação covalente entre os átomos de hidrogênio na molécula de H 2e a ligação dupla entre os átomos de oxigênio na molécula de O 2são quebradas, e novas ligações covalentes entre átomos de hidrogênio e oxigênio são formadas na molécula de H 2O.
Importância do balanceamento de equações químicas
O balanceamento de equações químicas é crucial para garantir que a lei de conservação de massa seja respeitada em uma reação química. A lei de conservação de massa afirma que a massa total dos reagentes é igual à massa total dos produtos em uma reação química.O balanceamento de equações químicas envolve ajustar os coeficientes estequiométricos na frente de cada fórmula química para que o número de átomos de cada elemento seja o mesmo em ambos os lados da equação.
Por exemplo, a equação química não balanceada para a combustão do metano é:CH4+ O 2→ CO 2+ H 2OPara balancear a equação, precisamos adicionar um coeficiente 2 na frente do O 2e um coeficiente 2 na frente do H 2O:CH 4+ 2O 2→ CO 2+ 2H 2O
Tipos de reações químicas
As reações químicas podem ser classificadas em diferentes tipos, de acordo com os reagentes e produtos envolvidos e com as mudanças que ocorrem durante o processo. A classificação das reações químicas em diferentes tipos é fundamental para a compreensão da química e para o desenvolvimento de novas tecnologias.
Reações de síntese
As reações de síntese, também conhecidas como reações de combinação, são aquelas em que duas ou mais substâncias reagem para formar uma única substância mais complexa.
A + B → AB
- Exemplo 1: A reação entre o sódio (Na) e o cloro (Cl 2) para formar o cloreto de sódio (NaCl):
- Exemplo 2: A reação entre o carbono (C) e o oxigênio (O 2) para formar o dióxido de carbono (CO 2):
2Na + Cl2→ 2NaCl
C + O2→ CO 2
Reações de decomposição
As reações de decomposição são o oposto das reações de síntese. Nessas reações, uma única substância se decompõe em duas ou mais substâncias mais simples.
AB → A + B
- Exemplo 1: A decomposição do carbonato de cálcio (CaCO 3) em óxido de cálcio (CaO) e dióxido de carbono (CO 2):
- Exemplo 2: A decomposição da água (H 2O) em hidrogênio (H 2) e oxigênio (O 2):
CaCO3→ CaO + CO 2
2H2O → 2H 2+ O 2
Reações de simples troca
As reações de simples troca, também conhecidas como reações de deslocamento, envolvem a troca de um elemento ou íon entre dois reagentes.
A + BC → AC + B
- Exemplo 1: A reação entre o zinco (Zn) e o ácido clorídrico (HCl) para formar cloreto de zinco (ZnCl 2) e hidrogênio (H 2):
- Exemplo 2: A reação entre o ferro (Fe) e o sulfato de cobre (CuSO 4) para formar sulfato de ferro (FeSO 4) e cobre (Cu):
Zn + 2HCl → ZnCl2+ H 2
Fe + CuSO4→ FeSO 4+ Cu
Reações de dupla troca
As reações de dupla troca envolvem a troca de íons entre dois reagentes, formando dois novos produtos.
AB + CD → AD + CB
- Exemplo 1: A reação entre o cloreto de sódio (NaCl) e o nitrato de prata (AgNO 3) para formar cloreto de prata (AgCl) e nitrato de sódio (NaNO 3):
- Exemplo 2: A reação entre o ácido clorídrico (HCl) e o hidróxido de sódio (NaOH) para formar cloreto de sódio (NaCl) e água (H 2O):
NaCl + AgNO3→ AgCl + NaNO 3
HCl + NaOH → NaCl + H2O
Reações endotérmicas e exotérmicas
As reações químicas podem ser classificadas em endotérmicas e exotérmicas, dependendo da troca de calor com o ambiente.
Reações endotérmicas
As reações endotérmicas absorvem calor do ambiente, resultando em um aumento da temperatura do sistema.
- Exemplo 1: A fusão do gelo é uma reação endotérmica, pois o gelo precisa absorver calor do ambiente para se transformar em água líquida.
- Exemplo 2: A fotossíntese, realizada pelas plantas, é um processo endotérmico, pois as plantas absorvem energia luminosa do sol para produzir glicose a partir de dióxido de carbono e água.
Reações exotérmicas
As reações exotérmicas liberam calor para o ambiente, resultando em uma diminuição da temperatura do sistema.
- Exemplo 1: A combustão da madeira é uma reação exotérmica, pois a madeira libera calor e luz ao reagir com o oxigênio do ar.
- Exemplo 2: A explosão de dinamite é uma reação exotérmica que libera uma grande quantidade de energia em forma de calor e luz.
As reações químicas são um processo fundamental que governa a transformação da matéria e impulsiona a vida em nosso planeta. Ao compreender os princípios básicos das reações químicas, podemos desvendar os mistérios da natureza e desenvolver novas tecnologias para melhorar a vida humana.
A partir do conhecimento sobre os reagentes, produtos, tipos de reações e balanceamento de equações, podemos prever e controlar as reações químicas, abrindo caminho para a inovação e o desenvolvimento científico.

